Het atoom
- Gegevens
- Gemaakt op maandag 21 maart 2022 17:12
- Laatst bijgewerkt op woensdag 23 juli 2025 17:47
- Gepubliceerd op maandag 21 maart 2022 17:23
- Hits: 3220
wat is materie?
In verwondering vragen wij: wat is dat alles wat wij zien, aanraken, horen, ruiken en proeven? Hoe is het opgebouwd en hoe is het ontstaan?Ooit zijn wij namen aan alles in de wereld om ons heen gaan geven. Datgene waarover wij lopen, noemen wij aarde en die aarde bestaat weer uit klei, steen, zand en stof. Die aarde kan weer droog of nat zijn. Dat wat wij boven ons zien noemen wij de hemel, de wolken de sterren, de zon en de maan. Dat wat wij om ons heen zien, zijn planten, bomen, dieren en de ander gaan heten. Dat daar is een boom en hij is gemaakt van hout. Het zijn de dingen of materie waar wij mee in aanraking komen. Namen zijn ons niet genoeg. Wat kun je met de dingen om ons heen doen? Hoe zit de materie in elkaar? Hoe is de materie gevormd?
Met het beantwoorden van al die vragen proberen wij ons te bevrijden van de angst en dreiging van het onbekende. De oermaterie
De Griekse filosofen vroegen zich al ruim voor de westerse jaartelling af af hoe al die dingen om ons heen ofwel materies zijn opgebouwd. Er was een gedeeld idee dat er zoiets moest zijn als prote hyle: oermaterie en of apeiron: het onbeperkte. uit deze oermaterie zouden vervolgens de oerelementen water lucht vuur en aarde zijn ontstaan.
Thales van Milete( 624–546 v.Chr) sprak over water als zijnde het zichtbare en kenbare oerelement waar alle andere materie of elementen vervolgens uit zijn ontstaan. Zijn leerling Anaximander en diens leerling Anaximeness spraken over lucht.
Volgens Empedocles van Acragas, Sicilië(492 v.Chr. – ca. 432 v.Chr.) was water de vloeibare vorm van materie, aarde de vaste vorm en lucht de gasvorm. In vuur zag hij als vorm warmte en licht. Twee natuurkrachten, Liefde en Strijd, werken daar op in en zorgen voor ontstaan en vergaan van de dingen. De krachten nemen om de beurten toe en af in dominantie, zodat de kosmos een eeuwige cyclus doormaakt van toenemende scheiding en vereniging. Leven ontstaat door een balans van beide.
Xenophanes van Colophonstelde dat alles is geboren uit het oerelement aarde en uiteindelijk terugkeert naar de aarde.
Het atoomidee
 Democritus van Abdera, een Griekse wiskundige,
astronoom en filosoof, die ca. 460 – 370 voor het begin van de westerse jaartelling leefde, stelde dat de wereld is opgebouwd uit uiterst kleine deeltjes die niet meer gedeeld kunnen worden. Deze deeltjes noemde hij atomos wat ondeelbaar betekent.
Democritus van Abdera, een Griekse wiskundige,
astronoom en filosoof, die ca. 460 – 370 voor het begin van de westerse jaartelling leefde, stelde dat de wereld is opgebouwd uit uiterst kleine deeltjes die niet meer gedeeld kunnen worden. Deze deeltjes noemde hij atomos wat ondeelbaar betekent.
 Epicurus(341–270 v.Chr.), een Griekse filosoof die voortbouwde op de ideeën van Democritus stelde op grond van redeneren:
Epicurus(341–270 v.Chr.), een Griekse filosoof die voortbouwde op de ideeën van Democritus stelde op grond van redeneren:
- Alles bestaat uit atomen en lege ruimte.
- Atomen zijn onveranderlijke, ondeelbare en eeuwige deeltjes, verschillend in grootte en vorm.
- Atomen vallen omlaag in een oneindig universum, maar soms wijken ze spontaan af: dit heet de clinamen.
- Door deze spontane afwijking kunnen atomen botsen en samenklonteren, wat leidt tot de zichtbare wereld.
- De ziel bestaat ook uit atomen en vergaat bij de dood. Er is geen hiernamaals.
- De goden bestaan misschien, maar ze bemoeien zich niet met de wereld.
- De atoomleer heeft als doel: vrijheid van angst en een gelukkig leven — geen vrees voor goden of de dood.
De visie van Aristoteles werd ondanks hé latere werk van Epicures, Lucretius en Al Razi, dominant in de Westerse wereld, vooral door invloed van de katholieke kerk. Daardoor raakte het atoomidee eeuwenlang in de vergetelheid.
- Epicurus (341–270 v.Chr.) stelde dat alles bestaat uit atomen en lege ruimte.
- Atomen zijn onveranderlijke, ondeelbare en eeuwige deeltjes, verschillend in grootte en vorm.
- Atomen vallen omlaag in een oneindig universum, maar soms wijken ze spontaan af: dit heet de clinamen.
- Door deze spontane afwijking kunnen atomen botsen en samenklonteren, wat leidt tot de zichtbare wereld.
- De ziel bestaat ook uit atomen en vergaat bij de dood. Er is geen hiernamaals.
- De goden bestaan misschien, maar ze bemoeien zich niet met de wereld.
- De atoomleer heeft als doel: vrijheid van angst en een gelukkig leven — geen vrees voor goden of de dood.
- Titus Lucretius Carus (ca. 99–55 v.Chr.) schreef het leerdicht De rerum natura ("Over de natuur der dingen").
- In dit Latijnse werk (6 boeken) werkte hij de filosofie van Epicurus uit tot een poëtische beschrijving van de natuur op basis van atomen.
- Het werk behandelt kosmos, leven, ziel, zintuigen, ziekte en dood — allemaal in termen van atomen en lege ruimte.
- Lucretius benadrukt dat natuurkennis leidt tot innerlijke rust: zonder bijgeloof, angst of morele verwarring.
Het atoom idee wordt zo'n 1500 jaar verlaten
Behalve in de Arabische wereld waar wiskunde en astronomie enkele honderden jaren tot een grote bloei kwam werd in Europa uitsluitend het idee van Aristoteles aangehangen dat dat materie was, opgebouwd uit vier elementen: aarde, water, lucht en vuur. Al-Razi(865–925), een Perzische arts, alchemist, filosoof, stelde dat de wereld bestaat uit onvernietigbare deeltjes en een soort "lege ruimte" waarin deze bewegen — dit is vergelijkbaar met het Grieks atomisme van Democritus en Epicurus.Hij was geïnteresseerd in materiële processen, chemische reacties en het gedrag van stoffen in de praktijk (bijvoorbeeld in de alchemie). In de renaissance werden oude Griekse en Romeinse teksten veelal in kloosterbibliotheken, afgestoft en opnieuw bestudeerd.
Pierre Gassendi (1592–1655), een Franse priester en filosoof, probeerde de ideeën van Democritus te verenigen met het christendom. Hij blies het atoomconcept nieuw leven in.
Robert Boyle (1627–1691) verwierp de vier-elementenleer en stelde dat materie uit “corpuscules” bestond — kleine deeltjes die zich combineren tot stoffen.
Experimentele verkenningen van het atoom
John Dalton (1766–1844) een Engelse meteoroloog en scheikundige, kwam door de observaties van Lavoisier (1789), dat massa (het gewicht in grammen), niet veranderde na uitvoering experimenten, de wet van de constante massaverhouding – Proust (1801) en zijn eigen observatie dat gassen zoals stikstofoxiden (NO, NO₂, N₂O). zich met zuurstof kunnen verbinden in meervouden van een vaste verhouding, tot de conclusie dat atomen niet gemaakt of vernietigd worden bij chemische reacties.Dalton concludeerde dat:
Massa(gewicht) blijft behouden → omdat atomen behouden blijven.
Stoffen reageren in vaste verhoudingen → omdat ze bestaan uit kleine ondeelbare eenheden (atomen) die in telbare aantallen met elkaar combineren.
Deze gedachte was revolutionair en de eerste echte bewijsvoering voor het bestaan van atomen en dat atomen, bouwstenen van de materie zijn.
Verder kwam hij tot de conclusie dat verschillende chemische elementen bestaan uit verschillende atoomsoorten en dat chemische verbindingen worden gevormd door combinatie van atomen van verschillende elementen. Concreet bedoelde Dalton met een element: Een zuivere stof die niet verder ontleed kon worden in andere stoffen bij een chemische reactie. Zoals: Waterstof (H) Zuurstof (O) Stikstof (N) Koolstof (C) Zwavel (S) Fosfor (P) Ijzer (Fe) J.J. Thomson ontdekte in 1897 het elektron tijdens experimenten met kathodestraalbuize door het gedrag van deze stralen in elektrische en magnetische velden te bestuderen. Hij leidde uit deze experimenten af dat elektronen, universele, negatief geladen deeltjes met massa zijn en veel lichter dan atomen. Rutherford (1911) ontdekte dat atomen een positieve kern hebben met bijna alle massa. Hij toonde aan dat de elektronen daaromheen bewegen. Henry Moseley (1913) ontdekte met behulp van röntgenstraling bij verschillende elementen een systematisch verband tussen de vrijgekomen frequentie van röntgenstraling na het bestralen van de positieve ladingen (protonen) in de kern en daarmee ook het aantal uiteraard negatieve elektronen (z) Niels Bohr (1913) realiseerde zich dat de klassieke natuurkunde niet goed kon verklaren wat er op atomair niveau gebeurt. Uitgaande van positieve protonen en negatieve elektronen zou men verwachten dat de elektronen naar de kern zullen spiraliseren en aldaar versmelten. Dat gebeurt echter niet.
Bohr beriep zich op de kwantummechanica(De wetenschap die tracht de wetten op het niveau van het allerkeinste te ontrafelen: te weten het atoomniveau. Volgens Bohr kunnen elektronen zich alleen op specifieke energieniveaus bevinden en is het daarom onmogelijk met de kern samen te smelten. De exacte redenen hiervoor kon Bohr niet verklaren. Ook het probleem dat de stelling van een specifiek energieniveau niet strookt met het onzekerheidsprincipe van Heisenberg, kon Bohr niet verklaren. Erwin Schrödinger(1926), Oostenrijkse natuurkundige stelde voor dat, in plaats van dat de elektronen in vaste banen of schillen bewegen, de elektronen zich als golven gedragen. Dit lijkt een beetje raar maar ook licht gedraagt zich zowel als een golf en als een deeltje. Het blijkt dat elektronen dat ook kunnen.
Zijn model toont de kern omringd door wolken waar de elektronen waarschijnlijk zijn. Deze gebieden van de ruimte rondom het proton worden elektronenorbitalen genoemd. James Chadwick (1932) Engelse natuurkundige ontdekte het bestaan van het neutron. Hiermee werd ons beeld over de subatomaire deeltjes waaruit een atoom bestaat, compleet. Sindsdien is ontdekt dat de protonen en neutronen waaruit de kern bestaat zelf deelbaar zijn in deeltjes die quarks worden genoemd. Tegenwoordig aanvaarden wij dat materie, het universum, de aarde en alles wat er leeft inderdaad bestaat uit atomen. Wat verstaat de wetenschap tegenwoordig onder atomen? Voor wij daar nader op ingaan constateren wij dat er ondanks vele observaties, veel geteste en afgeleide kennis, ook veel onzekerheden over atomen bestaan. Daarom is het goed ons te realiseren dat wanneer wij over atomen praten, wij net als Dalton en Democritus eigenlijk over een atoommodel praten. Ook het tegenwoordige beeld dat wetenschappers hebben van atomen is daarom niet meer dan een model ofwel een educated guess. Atomen staan voor elementen
Elk atoom vertegenwoordigt een element. Het meest voorkomende atoom of element in het universum is waterstof. Tot nu toe kennen wij 118 verschillende elementen of atomen
Afhankelijk aan wie je het vraagt onderscheidt men 94 tot 98 elementen die van nature voorkomen. Element 43:technetium, (Grieks voor kunstmatig), element 61: promethium en element 85: astatine werden eerst in het laboratorium gesynthetiseerd voor zij in de natuur werden gevonden. De andere elementen elementen die werden gesynthetiseerd zijn element 95 tot en met 118.
Voorbeelden van elementen die van nature voorkomen zijn: waterstof, helium, zuurstof, stikstof, koolstof, ijzer, lood, aluminium, koper, zilver, goud, platina en uranium.
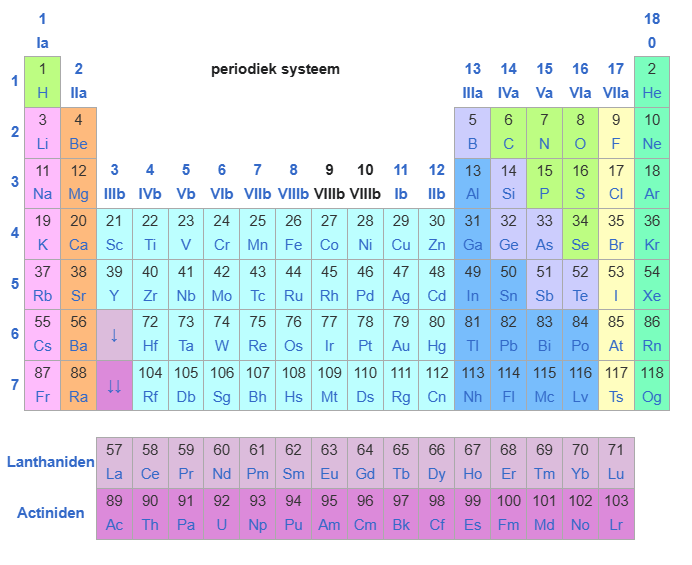
Elementen worden internationaal aangeduid met een latijnse naam. Waterstof heet hydrogenium en wordt afgekort met H. Helium blijft Helium en wordt aangeduid met He. Zuurstof in het Latijn is oxygenium en wordt afgekort met O. Stikstof heet Nitrogenium en wordt afgekort met N. Koolstof heet carbonium en wordt afgekort met C. IJzer in het latijn is ferrum en wordt afgekort met Fe. Koper is cuprum en wordt afgekort met Cu enz. Alle elementen en hun Latijnse namen zijn te vinden in het zogenaamde periodieke systeem. Een atoom is onvoorstelbaar klein
Bijzonder aan een atoom is dat het verschrikkelijk klein is. Om een indruk te krijgen: Een gemiddelde menselijke lichaamscel is 10 keer zo klein als een haardikte. Wij hebben een microscoop nodig om zo’n cel te zien. Deze piep, piep, piepkleine cel is opgebouwd uit 100 biljoen atomen.
In de kern van een atoom bevinden zich protonen en neutronen deze zijn uiteraard nog veel kleiner dan het atoom; veeeeeel kleiner. Ergens om de kern zijn de elektronen. Deze zijn nog veel kleiner dan de protonen en de neutronen.
Om ons voorstellingsvermogen een indruk te geven moeten wij ons de protonen en neutronen in de kern voorstellen als een rijstkorrel die in het midden van de grasmat van de Johan Cruyff Arena ligt, De elektronen bevinden zich dan ergens aan de buitenkant van het stadion en zijn meer dan 1800 keer zo klein als die rijstkorrel op de grasmat. In de onderstaande video vertelt Carl Sagan over het atoom
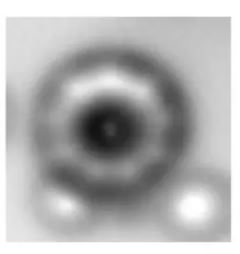 Atomen zijn zo klein dat zij tot voor kort alleen afgeleid konden worden door spectrografie. .
Atomen zijn zo klein dat zij tot voor kort alleen afgeleid konden worden door spectrografie. .
Met de huidige microscopische technieken zoals Cryogene elektronen microscopie en Atomic Force Microscopy is het wetenschappers in Oxford in augustus 2019 gelukt een foto te maken van een ring van 18 koolstof atomen. Op deze foto zijn deze atomen, weliswaar nog heel vaag maar toch zichtbaar. Hoe stelt men zich een atoom voor?
Met behulp van al bekende eigenschappen trachtte o.a. Rutherford(1911)
 zich een beeld te vormen van het atoom.
zich een beeld te vormen van het atoom.
In het atoommodel van Rutherford cirkelen lichte elektronen als een wolk om een positief geladen zware kern. In de klassieke natuurkunde zenden bewegende ladingen echter elektromagnetische straling uit, zodat het atoom niet stabiel zou zijn. De negatief geladen elektronen die zich ergens in een wolk of schil om de positief geladen protonen en neutrale neutronen, bevinden zouden elkaar dan aantrekken en elkaar opheffen
Om aan dit probleem te ontkomen, postuleerde Niels Bohr(1913) dat de elektronen zich alleen in banen kunnen bevinden op specifieke afstanden van de kern, en dat een elektron in zo'n baan geen straling uitzendt en daardoor niet door de positief geladen protonen opgeheven kunnen worden..
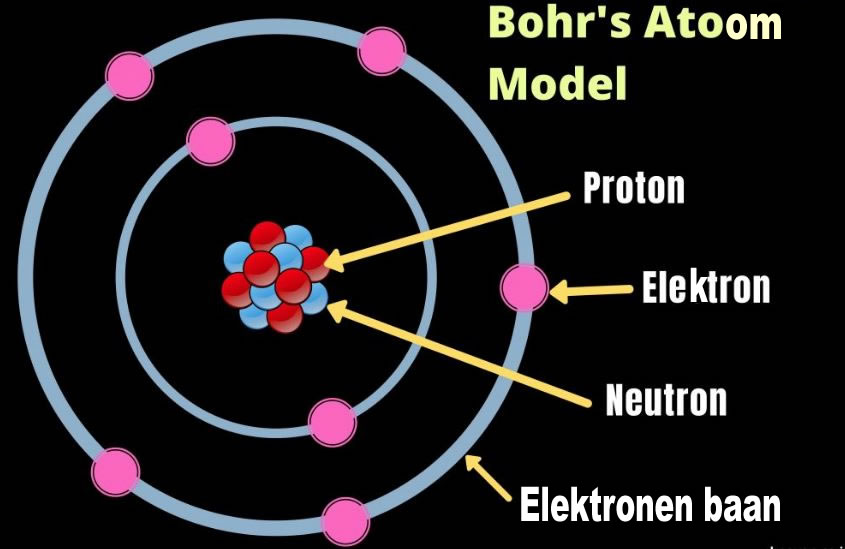
De protonen en neutronen in de kern worden omcirkeld door elektronen in een "baan" rond de kern. Men stelt zich het atoom voor als een bolvormige driedimensionale ruimte. In het midden van die ruimte van het atoom zit de kern. De kern bestaat uit elektrisch positief geladen protonen en neutronen zonder lading. Rondom de kern kunnen negatief geladen elektronen gemeten worden. Daar het elektron beweegt is de positie nooit met zekerheid te bepalen. Wat wel uiterst nauwkeurig te bepalen is, is de waarschijnlijkheid waar het elektron te vinden is. Hoe dichter bij de kern, hoe waarschijnlijker het is dat een elektron daar gemeten kan worden. Daar dit zeer veel posities zijn wordt dit vergeleken met een wolk van posities: een elektronenwolk. Ook al gaat het zoals het geval is bij het waterstofatoom om één elektron. Elektronen volgens de kwantummechanica
Een vaak gestelde vraag over positieve lading van het proton en de negatieve lading van het elektron is: Hoe komt het dat de negatief geladen elektronen niet neer storten op het positief geladen proton? Een positieve en een negatieve elektrische lading trekken elkaar immers aan. Wij moeten bedenken dat dit een enorme consequentie zou hebben want als dat zou gelden zou het universum niet kunnen bestaan. Elektronen vallen dus niet terug in de kern.
Terug naar de vraag: hoe het komt dat elektronen niet neerstorten op het proton. Dat komt omdat er in de wereld van het allerkleinste, andere wetten gelden dan in de voor ons zichtbare wereld. Wij betreden nu de wereld van de kwantummechanica. De kwantummechanica beschrijft hoe materie zich gedraagt op de schaal van moleculen, atomen, de subatomaire deeltjes: elektronen, protonen, neutronen, hun beweging en interactie. In de kwantummechanica stelt men zich een elektron voor als gekwantificeerde golffuncties die zich in de ruimte verspreiden en zich soms op beperkte manieren als deeltjes kunnen gedragen.
In gewoon Nederlands betekent dat men aan de hand van het energieniveau van het atoom een groot aantal mogelijke posities (kwanta) berekent waar het elektron zich zou kunnen bevinden. Volgens Heisenberg(1927) is het namelijk onmogelijk om een precieze positie berekening van het elektron te berekenen. Om het nog gekker te maken het elektron of kwantum kan zich op meerdere plaatsen tegelijk bevinden.
De kwantummechanica stelt dat atomen zich voortdurend in een bepaalde energietoestand bevinden. Hoe meer energie in het atoom hoe verder de elektronen van de kern zullen zijn. In de kwantummechanica spreekt men van niveaus van energie.
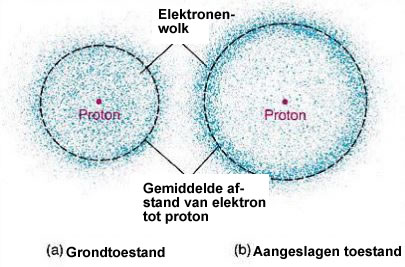
De kwantummechanica schrijft voor dat wanneer een elektron zich in het energieveld van een atoomkern bevindt, het elektron slechts een bepaald energieniveau in de buurt van deze kern kan bezetten. Wanneer het elektron op een dergelijk energieniveau rust, straalt het niet en kan geen energie verliezen. Het energieniveau dat de laagste energie heeft wordt de grondtoestand genoemd. Dus zelfs als elektronen zich dicht bij de kern van het atoom bevinden, verbiedt de kwantummechanica dat elektronen naar de kern vallen. De lading van het atoom
Het aantal elektronen bepaalt de lading van het atoom, De massa van de kern van het atoom
De positief geladen kern van het atoom maakt 99,9% van de massa van het atoom uit, maar slechts plusminus 1/100.000 van zijn volume. Het atoomnummer
Het aantal protonen in de kern van het atoom bepaalt welk element dit atoom vertegenwoordigt. Het atoomnummer (het aantal protonen) bepaalt de chemische eigenschappen van een atoom. Zo is het atoomnummer van waterstof 1 wat betekent dat een waterstof atoom, één proton en één neutron in de kern en één elektron in de schil. Alle atomen van andere elementen hebben meer protonen, neutronen en elektronen. Het veel zwaardere uranium atoom heeft 92 protonen, 92 neutronen in de kern en 92 elektronen in de schil. Het atoomnummer van koolstof 6 bepaalt dat het atoom koolstof 6 protonen, 6 neutronen in de kern heeft en 6 elektronen in de schil. Een neutraal atoom
Normaliter heeft een atoom een gelijk aantal protonen als neutronen.Dat heet een neutraal atoom. Isotopen
Er zijn atomen die geen gelijk aantal protonen en neutronen hebben. Deze atomen noemt men isotopen ofwel variaties van een element.
het aantal neutronen bepaalt welke isotoop van het specifieke element wordt weergegeven. Voorbeelden Waterstofisotopen:
Waterstof-1 (¹H) → 1 proton, 0 neutronen.
Deuterium (²H) → 1 proton, 1 neutron.
Tritium (³H) → 1 proton, 2 neutronen. Voorbeelden Koolstofisotopen:
Koolstof-12 (¹²C) → 6 protonen, 6 neutronen.
Koolstof-14 (¹⁴C) → 6 protonen, 8 neutronen (gebruikt bij koolstofdatering!). Ionen
Een atoom dat elektronen heeft gewonnen of verloren, wordt negatief of positief geladen en wordt een ion genoemd.
Kationen (positieve ionen) → atoom verliest elektronen.
Bijvoorbeeld: Natriumion (Na⁺) → Natrium (Na) heeft 11 protonen en verliest 1 elektron → wordt Na⁺. Anionen (negatieve ionen) → atoom neemt elektronen op.
Bijvoorbeeld: Chloride-ion (Cl⁻) → Chloor (Cl) heeft 17 protonen en neemt 1 elektron op → wordt Cl⁻. Geëxciteerde atomen
Een atoom kan energie absorberen, waardoor een elektron naar een hoger energieniveau springt. Dit noemen we een geëxciteerd atoom.
Een energiebundel (zoals licht of hitte) raakt een atoom.
Een elektron absorbeert energie en springt naar een hogere schil, Wanneer het elektron energie verliest straalt het licht uit. Quarks
Men veronderstelt dat het proton ook uit deeltjes bestaat en wel uit twee up quarks en een downquarks. De veronderstelde massa van de 3 quarks is echter maar 0,2% van de massa van het proton. De rest veronderstelt men bindingsenergie te zijn. Gluonen
De quarks zijn weer verbonden door gluonen. Men stelt zich de gluonen voor als spiraalveren. Die voortdurend in beweging zijn.
Moleculen

Wat is nu een watermolecuul? Stel je voor dat je een liter water eindeloos splitst in een steeds kleinere hoeveelheid water. De hoeveelheid wordt op een gegeven moment zo klein dat je deze met het blote oog niet meer kunt waarnemen. Op een bepaald moment houdt je 1 watermolecuul over. Met een super microscoop is dat nog net niet te zien.
Ook een watermolecuul kun je spitsen en wel in 2 atomen waterstof: H2 en een atoom zuurstof: O. Water is dus een samenklontering van 2 elementen: waterstof en zuurstof.
Wanneer je het zuurstof atoom in het watermolecuul, even laat voor wat het is, kun je daarna alleen de 2 waterstof atomen nog splitsen. Je houdt dan 1 waterstof atoom over. Omdat waterstof atoom het lichtste in het heelal is, is dit dus het allerkleinste deel waarin het molecuul water op te splitsen is.
Scheikunde
Scheikunde of chemie is de wetenschap die zich bezig houdt met het bestuderen, hoe atomen van verschillende elementen zich aan elkaar binden samenklonteren of juist uit elkaar vallen. Men doet dat door bijvoorbeeld te onderzoeken hoe elementen reageren wanneer ze samen worden gebracht en vervolgens de temperatuur te veranderen, de lichtsterkte aan te passen of de druk op elementen te verhogen. Onderzocht wordt, uit welke atomen(elementen) en moleculen materialen bestaan en met welke atomen nieuwe moleculen en materialen te maken zijn.Het waterstofgas in het molecuul water is bijvoorbeeld vrij te maken door in water een elektrische stroom te laten lopen. Een spontaan chemisch proces, namelijk: roesten, treedt op wanneer ijzer blootgesteld is aan water en het gas zuurstof in de lucht. Een deel van het ijzer gaat dan over in ijzeroxide ofwel (roest).
De fundamentele krachten in het atoom
Wetenschappelijke inzichten in de 18e, 19e en 20e eeuw stellen dat in atomen vier fundamentele natuurkrachten werkzaam zijn. Deze krachten zijn de sterke kernkracht, de elektromagnetische kracht, de zwakke kernkracht en de zwaartekracht. Over de zwaartekracht later meer. De elektromagnetische krachtDe elektromagnetische kracht in atomen is verantwoordelijk voor de positief geladen protonen en negatief geladen elektronen. Het neutron - de naam zegt het al - heeft geen lading.
De overkoepelende naam waarmee protonen en neutronen in de kern worden aangeduid is hadron of atoom hadronen. Wanneer wij het hebben over elektronen, protonen, neutronen, en quarks spreken wij ook van elementaire deeltjes ofwel deeltjes waaruit de elementn zijn opgebouwd. De sterke kernkracht
De sterke kernkracht die alleen werkzaam is in de kern van het atoom houdt de protonen bij elkaar. Dit ondanks dat de protonen allemaal door de elektromagnetische kracht positief geladen zijn. De sterke kernkracht is onveer 100 keer sterker dan de elektromagnetische kracht. De protonen en neutronen zijn opgebouwd uit up quarks en downquarks. Men gaat er van uit dat de sterke kernkracht wordt doorgegeven door gluonen. De zwakke kernkracht
De zwakke kernkracht, ook zwakke kracht of zwakke wisselwerking, tussen zware W- en Z-bosonen. Het bekendste effect van de zwakke kernkracht is bètaverval: de emissie van elektronen door neutronen of van positronen door protonen, die, en de daarmee geassocieerde radioactiviteit beïnvloedt
• neutrino's
• geladen leptonen
• quarks
De zwakke kernkracht stelt leptonen en quarks in staat energie, massa en lading met elkaar uit te wisselen. De zwakke kernkracht is beperkt tot in de atoomkern. Je kunt dan de vraag stellen; hoe komt het dat atomen en elementen aan elkaar klonteren? Wat wij waarnemen is dat elk systeem in de natuur streeft naar een stabiele energie toestand. Een systeem van samengeklonterde atomen heeft een stabielere energie toestand als los voorkomende atomen. Dat weten wij omdat samengeklonterde atomen minder energie hebben dan de energie van hetzelfde aantal los voorkomende atomen bij elkaar opgeteld. Dat betekent dat bij het samenklonteren van atomen energie vrijkomt en wanneer wij de samengeklonterde atomen weer willen bevrijden dat wij weer deze energie moeten toevoegen. Deze vrijgekomen of toegevoegde energie noemen wij bindingsenergie.
Wanneer wij daarna bedenken dat Albert Einstein in 1905 kwam met E=M x C2wat betekent dat energie gelijk is aan massa, is ook te begrijpen dat het aantonen van het lichtere gewicht van samengeklonterde atomen - bijvoorbeeld in een molecuul – vergeleken met de losse atomen ook verklaart dat samengeklonterde atomen minder energie hebben.
Ook werd aangetoond dat de kern bestaande uit protonen en neutronen van een atoom lichter is, dan wanneer de protonen en neutronen los van elkaar gewogen worden. Kernsplijting
Nu we weten hoe klein atomen zijn, is het nog onvoorstelbaarder dat het splijten van atoomkernen genoeg energie oplevert om een hele provincie van stroom te voorzien en dat het fuseren van diezelfde kern zoals dat in de zon gebeurt nog eens vier keer zoveel energie oplevert.
Literatuur
Bryson, Bill. Een kleine geschiedenis van bijna alles, Atlas, Amsterdam, (2015)Chaisson, E.McMillan, S. Astronomy Today. Pearson Prentice Hall, Upper Saddle River, (2005)
Websites:
Waarom komen elektronen in het atoom niet de kern binnen?Waarom vallen elektronen niet in de kern van het atoom



